Proteinele Curs
-
Upload
alexandra-maria-rusu -
Category
Documents
-
view
221 -
download
0
Transcript of Proteinele Curs
-
8/3/2019 Proteinele Curs
1/9
PROTEINELE
Structura fiecrei proteine este determinat genetic.
Proteinele au roluri diferite n celul i respectiv n organism. La nivel
celular au rol specific, indispensabil pentru funcionarea corect a ansambluluicelular. Numrul de proteine identice ntr-o celul este foarte bine determinat.
Exemplu: transportorul pentru glucoz GLUT2 din celula hepatic valori
normale 150 000; sub 20 000 diabet.
Exist un echilibru ntre sinteza i degradarea proteinelor la nivel celular.
Rolul proteinelor
Structural (ex. compoziia membranelor celulare, histonele n ADN)
Funcional
o In metabolism (enzimele)
o Comunicarea ntre organe
Hormoni
Receptori hormonali
o Transportori
Prin membrane (glucide, aminoacizi)
ntre organe (albumine, apoproteinele)
o Sistemul contractil (miozina)
o Imunitate (imunoglobuline, sistemul complement )
o Coagulare (fibrina, fibrinogenul)
o In genetica celular (factori de transcripie, represori genici)
Fizico-chimic (meninerea echilibrului acido-bazic, osmotic)
Energetic
Structura proteinelor
1
-
8/3/2019 Proteinele Curs
2/9
Structura primar tipul, numrul i succesiunea aminoacizilor n caten.
Secvena aminoacizilor este rezultatul informaiei genetice. Indiferent de numrul
aminoacizilor dintr-o protein, fiecare lan va avea la unul din capete un aminoacid
cu gruparea NH2 liber (captul N terminal), iar la cellalt capt un aminoacid
cu gruparea COOH liber (captul C terminal. Prin convenie, secvena
aminoacizilor ntru-un lan polipeptidic se consider ntotdeauna de la captul N-
terminal spre captul C-terminal.
Structura secundar corespunde unor structuri spaiale regulate: helix,
pliat. Aceste structuri sunt realizate prin legturi disulfurice, ionice, de hidrogen,
hidrofobe. Aceste tipuri de structuri se datoreaz proprietilor spaiale a legturii
peptidice.
Structurile helix sunt stabilizate prin legturile de hidrogen intracatenare. Pe
fiecare spir a -helixului se afl 3, 6 resturi de aminoacizi. Legtura de hidrogen
se realizeaz ntre gruparea C=O i NH2 din dou spire vecine. Legturile de
hidrogen sunt paralele cu axul helixului. In proteinele naturale sensul de rotire al
helixului este spre dreapta (sensul acelor unui ceasornic).
Structurile pliate sunt stabilizate prin legturi de hidrogen intracatenare. Poate
fi cu lanuri paralele sau antiparalel.
2
-
8/3/2019 Proteinele Curs
3/9
Triplul helix al colagenului este realizat prin intermediul legturilor de hidrogen
intra i intercatenare. Acest tip de structur se datoreaz prezenei prolinei i
hidroxi-prolinei. Aceti aminoacizi nu pot participa la legturi de hidrogen.
Structura colagenului prezint serii de trei aminoacizi n care glicina ocup aceeai
poziie. Glicina este poziionat n interiorul helixului. Fiecare spir conine un
astfel de triplet.
Gly-Ala-Pro Gly-Pro-Ala Gly-Pro-Pro(OH)
n figura de mai sus glicina este reprezentat cu rou.
Structura teriar se refer la aranjarea spaial a acestor structuri secundare
(poziionarea n spaiu a fiecrui atom). Este rezultatul unor legturi diverse
(hidrogen, hidrofobe, electrostatice, covalente) ntre aminoacizii aceleiai catene
dar care nu sunt vecini n structura primar. Datorit acestor interaciuni, lanul
polipeptidic nu poate adopta o structur ordonat n spaiu, pe toat lungimea sa, ci
structurile ordonate sunt separate de coturi sau bucle n care lanul polipeptidic nu
adopt o structur ordonat. Structura tridimensional a unei proteine native n
mediul su fiziologic este aceea pentru care energia liber a sistemului este
minim.
3
-
8/3/2019 Proteinele Curs
4/9
n funcie de structura teriar, proteinele se clasific n: fibrilare i
globulare.
Legturile din cadrul structurii teriare sunt mai mult sau mai puin stabile,
sunt influenate de mediu. De exemplu acizii i bazele tari intervin n legturile
electrostatice ceea ce determin denaturarea proteinelor. Legturile disulfurice se
realizeaz preponderent ntre resturi de cistein. Agenii oxidani i reductori
puternici pot oxida cisteina sau pot reduce legturile disulfurice denaturnd
proteina.
Structura cuaternarse ntlnete la proteinele formate din mai multe subuniti.
Este rezultatul unor legturi diverse (hidrogen, hidrofobe, electrostatice, covalente)
ntre aminoacizii din catene diferite dar care sunt unite ntr-o singur molecul.
Fiecare caten este denumit protomer. Structura cuaternar poate fi definit ca
numrul, tipul i modul de legare a subunitilor (protemerilor) dintr-o entitate
proteic cu activitate biologic bine definit.
Ruperea legturilor dintre catene duce la denaturarea proteinei. Exemplu :
hemoglobina este un tetramer
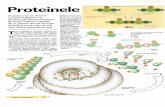
aminoaciziStructura primar a unei proteine :
Secvena aminoacizilor n caten
Structura secundar a unei proteine :
Legturi de hidrogen ntre aminoacizi
Structura teriar a unei proteine :Legturi ntre structurile secundare
plisat
helix
Structura cuaternar a unei proteine :Asocierea mai multor catene polipeptidice
plisat helix
STRUCTURA PROTEINELOR
4
-
8/3/2019 Proteinele Curs
5/9
Proprieti
1.solubilitatea depinde de mai muli factori :
- electroliii. Proteinele sunt solubile n soluii diluate de sruri neutre. Soluiileconcentrate produc denaturarea lor (precipitare). Se pot separa diferite clase de
proteine n funcie de concentraia la care precipit.
- pH-ul. Solubilitatea unei proteine este minim n vecintatea pHi.
- solvenii organici. Etanolul, metanolul i acetona determin precipitarea
proteinei.
2. determinarea masei moleculare (se situeaz ntre 10 000 i pn la peste 1 000000)
Metode :
- filtrarea pe gel de dextran. Se realizeaz o separare n funcie de mrimea
moleculei. Cele mai mari vor trece primele prin gel. Apoi se compara cu etaloane.
- ultracentrigugarea produce sedimentarea n funcie de densitate. Se compar cu
etaloane.
- electroforeza migrarea moleculelor ncrcate electric sub aciunea unei
diferene de potenial. Apoi compararea cu etaloane.
Clasificare
1. Dup compoziia chimic
- holoproteine formate numai din aminoacizi
- heteroproteine formate dintr-o parte proteic i o parte neproteic (parte
prostetic) legate prin legtur covalent. Partea neproteic este extrem de variat.
n funcie de natura ei ntlnim :
Parte neproteic Proteina
Glucide GlicoproteineLipide LipoproteineFosfat Fosfoproteine
Ion metalic Cromoproteine(Hb, citocromi)
5
-
8/3/2019 Proteinele Curs
6/9
2. Dup forma moleculei
Proteine fibroase sau scleroproteine. Sunt practic insolubile. Ex. colagenul,
keratina
Proteine globulare sau sferoproteine. Au form sferic sau ovoid.
6
-
8/3/2019 Proteinele Curs
7/9
3. Clasificarea n funcie de solubilitate
Albumine solubile n ap distilat. Precipit prin adugare de sulfat de
amoniu ntre 70 i 100% saturaie. Au caracter acid, pHi < 7.
Globuline insolubile n ap, solubile n soluii saline diluate (ex. NaCl 5%).
Precipit prin adugare de sulfat de amoniu pn la saturaia de 50%.
Protamine i histone solubile, talie mic, foarte bazice, pHi mare.
Globine solubile n ap
Prolamine i gluteline proteine vegetale insolubile n ap dar solubile n
soluii diluate de acizi i baze.
7
-
8/3/2019 Proteinele Curs
8/9
MIOGLOBINA
Este o hemoprotein (conine hemul) care are rolul de a fixa reversibil
oxigenul n muchi (l preia de la hemoglobin i l cedeaz mitocondriilor
musculare.Este alctuit dintr-un lan polipeptidic format din 153 aminoacizi. Are o
structur globular compact n care 77% din lanul polipeptidic reprezint o
structur de -helix iar 23% este o structur nehelicoidal. Se gsesc 8 segmente
helicoidale (notate cu literele A, B, C, D, E, F, G, H) intercalate cu 7 segmente
scurte nehelicoidale formate din 1-8 aminoacizi. n segmentele nehelicoidale
predomin prolina.Hemul se gsete ntr-o cavitate determinat de structura teriar a globinei. n
aceast cavitate se regsesc aminoacizi hidrofobi, ca urmare legturile dintre hem
i globin sunt legturi hidrofobe i cteva legturi electrostatice.
Fierul (Fe2+) este hexacoordinat (realizeaz 6 legturi).
8
-
8/3/2019 Proteinele Curs
9/9
Legtura dintre Fe2+ i globin se realizeaz prin intermediul a dou resturi
de histidin din poziia E7 ( His distal) i poziia F8 (His proximal). Aceste
legturi sunt perpendiculare pe planul hemului. Oxigenul se interpune ntre His
distal i ionul de Fe2+.
9