c5 Energia Hidrogenului
description
Transcript of c5 Energia Hidrogenului

Energia hidrogenului – Pile de Combustie
Unica sursa de energie care a alimentat civilizatia noastra pana in acest secol a fost energia solara inmagazinata sub forma de energie chimica, prin procesul de fotosinteza, in surse regenerabile ca lemnul, apele, vintul sau in combustibili fosili precum carbunele, petrolul, gazele naturale cu intervale de formare de ordinul milioanelor de ani.Una dintre problemele principale, de a carei solutionare depinde dezvoltarea civilizatiei umane, este asigurarea cu energia necesara dezvoltarii activitatilor de baza care conditioneaza evolutia progresiva a nivelului de trai al populatiei globului terestru. Cantitatea de energie consumata de omenire a crescut , din epoca primitiva pana acum de 2,5 milioane de ori. Omenirea a trecut, in domeniul energiei, de la lemn la carbune in sec. XIX, de la carbune la petrol in sec.XX iar acum exista indicii ca se pregateste o a treia tranzitie. Lumea pare a fi in pragul unei noi ere, a tehnologiilor avansate si a noi combustibili. Intrebarea este cat va fi ea de mare si rapida. Tranzitia in domeniul energiei va putea fi o revolutie tehnologica sau doar evolutie.Daca va fi o revolutie, omenirea va vedea in curand modalitati noi si complet diferite de a produce si a folosi energia. Electricitatea ar putea fi generata de surse cu poluare zero si folosita, apoi, pentru a genera hidrogen, care, la randul lui, ar alimenta consumatorii cu poluare zero. Daca rezultatul va fi o evolutie, s-ar putea ca omenirea sa continue sa foloseasca unii combustibili poluanti (carbunele, petrolul, gazul natural), gasind modalitati noi, mai curate si mai eficiente de utilizare a lor. Automobilele si centralele electrice isi vor dubla sau tripla randamentul, reducandu-si poluarea cu 90%. In loc sa fie construite cu centrale termice si aparate de aer conditionat, locuintele, birourile si chiar satele indepartate ar putea fi echipate cu pile de combustie - dispozitive compacte, ultracurate, care produc electricitate prin procedee chimice, avand ca produse secundare apa complet pura, caldura si foarte putina poluare atmosferica sau aproape deloc.
Principiile de functionare si tipuri de pile de combustie
Posibilitatea obtinerii energiei electrice prin conversia directa a energiei chimice a aparut odata cu ideea desfasurarii in sens invers a fenomenului de electroliza al apei. In anul 1801, Davy a realizat acest lucru utilizand carbonul drept combustibil si acidul nitric drept oxidant. Cercetarile au fost continuate ulterior de Ostwald, Nernst,Haber s.a. Conversia directa a energiei chimice in energie electrica evita veriga energiei termice si, deci, randamentul de transformare nu va depinde de limitele Carnot. Energia eliberata la oxidarea combustibililor conventionali, care e utilizata in general sub forma de caldura, poate fi convertita direct in energie electrica cu un randament excelent, intr-o pila de combustie. Se produc reactii redox in care are loc oxidarea combustibulului si reducerea oxidantului cu o pierdere din partea unuia si un castig de electroni pentru celalalt. Orice element galvanic implica o oxidare la polul negativ (pierdere de electroni) si o reducere la cel pozitiv (castig de electroni) iar pilele de combustie tind sa separe cele doua reactii partiale in sensul ca electronii schimbati trec printr-un circuit de utilizare exterior.

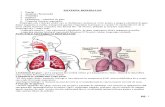
Fig. 1 Schema de functionare a unei pile de combustie1-electrozi porosi; 2-electrolit; 3- apa in fluxul de gaz; 4-curent electric.
Pentru desfasuararea procesului, este necesara realizarea unui element continand un anod , un catod si un electrolit care poate fi alimentat direct cu un combustibil si cu aer (figura.1). Oxigenul necesar arderii combustibilului este ionizat la catod, ionii migrand apoi in electrolit pentru a ajunge la anod unde se produce oxidarea combustibilului.
Principiul de functionarePentru a explica modul de functionare al unei pile de combustie se utilizeaza cea mai simpla pila si anume aceea care functioneaza cu hidrogen si oxigen. Procesele cinetice ireversiile asociate unei pile de combustie constau intr-o serie de rectii de oxido–reducere. Un comustibil notat “A” este transportat la anodul poros unde este adsorbit pe suprafata acestuia, apoi disociat in ioni si electroni intr-un proces de oxidare. Ulterior, are loc migrarea electronilor de la anod si eliberarea gazului ionic la suprafata anodului.
Fig.2 Schema de principiu a unei pile de combustie H2-O2 cu electrolit bazic
In electrolit bazic trebuie asigurat transportul ionilor Az+ de la anod la catod, impotriva campului electric rezultat pe axa campului imprimat electrochimic. La catod, se intalnesc ionii (sositi prin electrolit), electronii (sositi prin circuitul exterior) si oxidantul notat cu”B “. Are loc reactia de reducere, rezultand produsul de reactie ce trebuie eliminat. Pila de combustie se compune deci, din trei elemente: electrolitul, electrozii si rectantii (un combustibil si un oxidant).Vom exemplifica o pila de combustie folosind drept combustibil hidrogenul, drept oxidant oxigenul, electrolit alcalin hidroxid de potasiu (KOH) si electrozi ce joaca si
H2
Gaz combustibilO2 sau aer
3
2
4
1
2H2 4HO-
4H2OH2 nereactionatH2O vapori
O2
2H2O
Anod
Catod
HO--
KOH
4e- 4e-

rolul de catalizatori (pentru electrodul de hidrogen platina neagra, paladiul, iridiul iar pentru cel de oxigen nichel, aliaje Ni-Ag), in figura 3.
Fig.3 Schema de principiu a unei pile de combustie H2-O2 cu electrolit acid
In timpul functionarii electrozii nu sufera nici o modificare structurala ei servind doar ca suport pentru reactii; la anod are loc oxidarea catalitica a hidrogenului atomic iar la catod reducerea catalitica a oxigenului atomic. Fenomenul de oxidare si reducere catalitica are loc in regim trifazic (gaz-solid) la suprafata catalizatorului conform reactiei globale:
H2+1/2O2H2O.In cazul electrolitului bazic (KOH), au loc urmatoarele reactii.La catod oxigenul este adsorbit la suprafata electrodului unde reactioneaza cu apa, rezultand ionii hidroxil si perhidroxil conform reactiei:
O2 (adsorbit)+H2O+2e-(HO2)- + (HO)-.Ionul perhidroxil este nedorit deoarece reduce tensiunea pilei datorita fenomenului de polarizare si, de aceea, se cauta indepartarea lui prin folosirea de catalizatori adecvati.Reactia ideala este:
O2 (adsorbit)+2H2O+4e-4(HO-).Are loc un transport al ionului hidroxil (HO-) de la catod la anod unde se produce reactia cu hidrogenul pe suprafata catalizatorului anodic:
La anod au loc reactiile:2H2 (gaz)2H2 (adsorbit) 4H+,4H++ 4 (HO-)4H2O +4e-.
Adsorbtia hidrogenului pe suprafata catalitica a anodului produce atomi activi de hidrogen conform rectiilor de mai sus.
Importanta electrodului de hidrogen a celui de oxigenElectrodul de hidrogen (anodul) trebuie sa asigure: adsorbtia moleculei de hidrogen, activizarea ei, promovarea reactiei cu ionul hidroxil. Electrodul de oxigen (catodul) trebuiesa permita adsorbtia oxigenului molecular, promovarea rectiei cu apa.Folosirea electrolitului acid modifica reactiile in felul urmator:La anod:
2H2 (adsorbit)4H++4e-.
H2O
H2
2H2
4H+3/2O2
Anod
Catod
H+ 4H+
acid in solutie
4e- 4e-O2 sau aer
O2 nereactionatH2O vapori

Ionii de hidrogen difuzeaza prin electrolit pana la catod unde are loc reactia cu oxigenul rezultand apa.La catod:
4H++3/2O2 (adsorbit)+4e-H2O2 +H2O.Fata de pila cu electrolit alcalin cea cu electrolit acid asigura transportul ionic cu ioni de hidrogen fata de ionul hidroxil (HO)- iar apa ca produa al reactie globale va rezulta la catod (figura.3).Pentru a avea o reprezentare a ordinului de marime a tensiunii rezultate se foloseste reactia globala:
H2+1/2O2H2O, unde -G=+57,8 Kcal/gmol=+237,1Kj/gmolE =-G/ZF=237100/296493=1.229V
Se obtine o tensiune de 1,229 V la o temperatura normala (25°C). In realitate tensiunea poate scadea destul, datorita fenomenului de polarizare care inglobeaza o serie de pierderi de potential. Pierderile de potential reprezimta, de fapt pierderi de energie datorate mai multor cauze cum ar fi: polarizarea de concentratie, polarizare datorata mecanismului de reactie, polarizarea de activare si polarizarea ohmica. Important de precizat este ca de la o densitate de curent de 10 mA/cm2 polarizarea ohmica devine foarte importanta putand duce la pierderi care sa anuleze tensiunea electomotoare a tipului de pila considerat.
Probleme tehnice specifice ale pilelor de combustieRandamentul pilelor de combustieAlimentate cu hidrogen, PC il transforma prin procedee chimice in apa curata si in electricitate. Poluarea si zgomotul sunt zero. Pilele de combustie pot sa functioneze si cu combustibili bogati in hidrogen - ca gazul natural sau metanolul, de exemplu. Chiar daca acestia produc o oarecare poluare a aerului, ea este mult mai mica decat in cazul motoarelor conventionale. Emanatiile de oxizi de azot, de exemplu, sunt deseori atat de mici, incat nu pot sa fie masurate cu instrumentele, care se gasesc in ziua de azi pe piata. Cat priveste randamentul de ansamblu, cele mai slabe pile de combustie sunt superioare celor mai bune motoare conventionale. Un motor de automobil obisnuit, de exemplu, functioneaza cu un randament de aproximativ 25% - restul de benzina pierzandu-se sub forma de caldura - in timp ce o pila de combustie comparabila functioneaza cu un randament dublu, putandu-se atinge chiar si randamente de 75%.Fiind compacte, silentioase si cu o poluare scazuta sau zero, pilele de combustie pot sa fie amplasate si in centrele oraselor sau chiar in cladiri locuite, eliminandu-se necesitatea cablurilor si a traseelor de cabluri, cu pierderile de energie corespunzatoare. La fel de important este faptul ca energia calorica degajata de pilele de combustie poate sa fie folosita pentru incalzirea sau racirea aerului. Pilele de combustie sunt deja folosite experimental, iar in Japonia si SUA exista linii de asamblare, care au inceput sa le produca.
Electrozii pilelor de combustieCele trei faze de reactie a gazului cu lichidul pe suprafata catalizatorului prezinta dificultati de tratare datorita zonei mici de reactie. Avand pori de mici dimensiuni la suprafata de contact cu electrolitul si pori de mari dimensiuni pe cealalta parte, lichidul va patrunde doar pe o anumita portiune in electrod, aceasta depinzand de de presiunea gazului si structura electrodului. In acest fel, se obtine o mare suprafata de reactie care depinde de uniformitatea distributiei porilor pe suprafata

electrodului.Catalizatorul poate fi activat prin imersarea matricei poroase intr-o solutie catalitica,urmata de uscare si incalzire.S-a constatat ca o patura inactiva de metal sinterizat cu pori foarte fini care acopera un strat catalitic cu pori mai mari poate sustine presiunea in exces a gazului, fara pierderi, pentru ca lichidul umple porii mici datorita tensiunii superficiale.Electrodul este realizat prin presarea si sinterizarea unui amestec fin de nichel si otel,nichel-aluminiu,sau nichel-zinc. Aluminiul si zincul sunt mai tarziu inlaturati printr-o reactie electrochimica,rezultand o structura poroasa care contine particule active de nichel.
Fig.4 Mecanismul reactiei trifazice in electrodul poros
In concluzie,electrozii folositi trebuie sa indeplineasca urmatoarele conditii: stabilitatea structurala necesara pentru crearea si mentinerea suprafetei gaz/elecrolit si pentru realizarea circulatiei reactantilor; buna conductibilitate elecronica astfel incat sa se asigure transferul electronilor spre si de la centralele de transfer de sarcina; rezistenta al coroziunea provocata de elecrolitii puternic disociati(acizi,baze); activitate buna electrochimica necesara promovarii procesului de electrod; contact de interfata amxim pentru a permite realizarea unor densitati de curent mari; rezistenta la tendinta de blocare a centrelor active cu produsi de coroziune;
Electrolitul pilelor de combustiePentru ca o substanta sa indeplineasca rolul de electrolit intr-o pila de combustie este necesar sa fie indeplinite cateva conditii: stabilitate chimica ridicata in raport cu cei doi electrozi pentru a nu reactiona cu ei; puncte de topire si fierbere ridicate pentru pilele care functioneaza la temperaturi inalte; conuctivitate predominant ionica si absenta conductivitatii electronice

Elecrolitii lichizi cei mai uzuali sunt solutii bazice sau acide,fenomenul de transport chimic fiind similar cu cel de la electroliza solutiilor apoase.Sunt folositi la pilele care functioneaza la temperaturi scazute.Elecrolitii solizi capata in viitor o tot mai mare importanta pentru pilele de combustie care functioneaza la temperatura inalta sau joasa.Elecroliti in stare topita reprezinta un alt tip de elecroliti intrebuintati in constructia pilelor de combustie(carbonati in stare topita).Au fost realizate pile de combustie care fuctioneaza la 700°C cu elecrolit format dinttr-o matrice ceramica umpluta cu carbonat topit.Drept reactanti,s-au folosit oxidul de carbon si oxigenul. In pila au loc reactiile:La catod: ½ O2 +CO2 +2e- CO3
—
La anod: H2+ CO3— H2O + CO2 +2e-
CO+ CO3— 2 CO2+2e-
Combustibili si oxidanti E necesar a corela tipul combustibiliolor folositi cu pretul pe care il are fiecare dintre ei. Aceasta problema (combustibili folositi) intereseaza in principal din punct de vedere economic si tehnic adica daca surplusul de investitie compenseza surplusul de siguranta si folosire a unui anumit tip de combustibil.OxidantiCel mai uzual oxidant este aerul datorita oxigenului pe care il contine. Totusi cel mai folosit dar totodata si cel mai scump este hidratul de hidrazina, deci se pune problema gasirii unui combustibil care sa-l substituie . Daca electrolitul sau electronii reactioneaza cu bioxidul de carbon si alti componenti ai aerului, atunci se foloseste oxigen pur care este evident mai scump. Se mai pot folosi diverse substante, care pot elibera oxigenul: acid azotic, apa oxigenata, perclorati.CombustibiliPentru a putea fi utilizati intr-o pila de combustie, combustibilii trebuie sa posede o serie de proprietati fara de care nu se asigura o buna functionare a pilei, cum sunt: reactivitatea anodica; reactivitate nula sau mica fata de electrolit; eliminare usoara a produselor de combustie; solubilitate in electrolit; conservarea conductibilitatii electrolitului; volatilitate; stabilitate chimica in conditii normale; corozivitate redusa; securitate in utilizare, toxicitate redusa;
Tabelul 1
Avantajele si dezavantajele principalelor tipuri de oxidanti folositi in pilele de combustie
Oxidantul Avantaje DezavantajeOxigen lichid
Oxigen gazos comprimatla 150-200 atm
puritate disponibil sub presiune
functionare buna a electrodului
dificultati in transport greutate mare a recipientilor
pierderi prin evacuare
Oxigenul din aer disponibil peste tot nu necesita rezervoare posibilitati de racire
diluat de gaze inerte performante mai scazute puritate partiala redusa impuritati care trebuie
eliminate (CO2, S)

Apa oxigenata asigura, la electrod, contactul triplu
simplitate in utilizare
instabilitate nu se poate recupera pret relativ ridicat
Acid azotic pret relativ scazut asigura randamente bune
regenerabil cu O2
coroziunea materialelor membrana separatoare de
spatiu anodic nu e reglabil cu aer
Alti oxidanti peroxid de calciu perclorat de litiu
stocare usoara la volume mici cost ridicat risc de explozie
O serie de combustibili indeplinesc aceste cerinte, pe primul loc situandu-se hidrogenul. Se mai folosesc: metanolul, alcooli, hidrazina, hidrocarburi etc.Hidrogenul este cel mai convenabil combustibil datorita proprietatilor sale: reactivitate buna, difuzie rapida, polarizare de electrod redusa etc. Prin oxidarea hidrogenului, se produce apa care este un produs nepoluant, iar folosirea lui se face la temperatura abianta, cu o aparatura simpla. Hidrogenul poate fi folosit in mod direct, sub forma de hidrogen gazos depozitat in recipiente corespunzatoare. Depozitarea hidrogenului si vehicularea lui constituie cea mai delicata problema a pilelor care folosesc acest combustibil.Alta posibilitate este aceea de a folosi substante chimice care contin hidrogen si pe care pot sa il elibereze doar in momentul functionarii pilei. Un astfel de produs este amoniacul (NH3) care poate fi depozitat relativ usor, acesta prin disociere producand hidrogen si azot conform reactiei:
temperatura2NH3 3H2+N2.
In acelasi scop, se mai folosesc combustibili organici, cum sunt: metanolul si hidrocarburile usoare.Hidrazina are avantajul ca poate fi stocata fara probleme in solutie concentrata (60%) de hidrat de hidrazina (N2H4). Inconvenientul hidrazinei este acela ca este foarte scumpa, ceea ce face ca aplicatiile ei in cazul pilelor de combustie sa se rezume la domeniul militar.Combustibili organici ca: metanol, kerosen, combustibili lichizi se pot folosi dupa o prealabila reformare a lor pentru a se obtine un amestec de hidrocarburi gazoase usoare, oxid de carbon si hidrogen. Se folosesc electrozi de platina, electroliti acizi si, drept oxidant, aerul.Utilizarea directa a gazulului natural pentru a produce curent electric elimina filiera traditionala a termocentralelor. Pilele de combustie care folosesc gaz natural functioneaza la temperatura inalta, cu electrolit topit sau solid. Folosirea directa a hidrocarburilor usoare este ingreunata de reactivitatea lor chimica redusa la temperatura ambianta si de aceea, unele pile de combustie functioneaza la aproximativ 1000° C. Se pot folosi amestecuri de hidrocarburi ieftine rezultate ca deseu din procesele chimice care, de obicei, sunt eliminate sau arse. Conditiile severe de coroziune implica materiale scumpe si deficitare, ceea ce avantajeaza folosirea electrolitilor solizi chiar daca este necesara o temperatura mai mare de functionare.
Tipologia pilelor de combustieClasificarea pilelor de combustie se poate face dupa mai multe criterii care tin seama de anumite particularitati comune (combustibilul folosit, tipul electrolitului, temperatura de functionare etc.)

Dupa tipul combustibilului pilele se impart in: pile cu combustibili gazosi pile cu combustibili lichizi pile cu combustibili soliziIn functie de electrolitul folosit, avem urmatoarea clasificare: pile cu electrolit lichid - topitura de carbonati- acid (solutie apoasa)- bazic (solutie apoasa) pile cu electrolit solid- membrana din rasina- schimbatoare de ioni- cu structura cristalinaCel mai uzual mod de a clasifica pilele este acela care tine seama de temperatura de functionare, astfel: pile de temperatura joasa (reci) care functioneaza intre 20-80°C; pile de temperatura medie (calda) care functioneaza intre 200-300°C; pile de temperatura inalta (fierbinti) care functioneaza intre 400-800°C si in jur de 1000°C.Este evident ca aceste structuri ordonatoare se suprapun partial; de exemplu o pila fierbinte are electrolitul solid sau in stare topita, iar combustibilul nu poate fi decat gazos sau solid care este adus in faza gazoasa. Un alt mod de a clasifica pilele este acela care are in vedere cum se consuma combustibilul: directe (combustibilul se consuma in mod direct fara transformari intermediare) indirecte (combustibilul sufera o serie de transformari inainte de a intra in pila).
Pile directe hidrogen – oxigen (H2 – O2)Acest tip de pile consuma in mod direct hidrogenul , putand functiona la diverse temperaturi, datorita reactivitatii ridicate a acestuia. Se pot folosi diversi electroliti, iar in loc de oxigen se poate folosi aerul. Prima pila de combustie H2 – O2 a fost realizata in anul 1839 de Grove si dezvoltata, dupa 1933, de Bacon.Pile de temperatura joasa ( fig. 1 ) functioneaza, de regula, cu electrolit alcalin (KOH) sau acid (H2SO4) in solutie apoasa, avand avantajul unei largi palete de catalizatori si deci si de electrozi. Pila cu electrolit bazic asigura puteri specifice duble fata de cea cu electrolit acid, dar exista pericolul carbonatarii electrolitului cu bioxidul de carbon din aer.Pile de temperatura medie – functioneaza cu hidroxizi topiti amestecati cu o solutie de KOH la temperaturi de aprox. 200°C. Desi asigura cea mai mare putere specifica, pila prezinta acelasi inconvenient cu pilele de electrolit KOH solutie si anume carbonatarea insotita si de o corodare severa a recipentilor.Pile de temperatura ridicata – functioneaza cu electroliti din carbonati alcalini topiti la 400 - 800°C sau solizi la temperaturi de aprox. 1000°C. Desi are cele mai scazute puteri specifice datorate unor randamente slabe de reactie, aceste pile, indeosebi cele cu electrolit solid, permit utilizarea unor amestecuri de gaze deosebit de ieftine, care rezulta ca subproduse de reactie in industria chimica. Un alt avantaj consta in faptul ca poate fi folosit direct aerul. Cea mai recenta pila de acest tip pusa la punct de firma Westinghouse foloseste un combustibil format din 67% H2, 22% CO si 11% vapori de

H2O la o temperatura de 1000°C. Pila are forma tubulara la interiorul careia se gaseste catodul ( electrodul de aer ) constituit de un strat subtire de 1mm de strontiu dopat cu lantan si mangan. Urmeaza, in ordine, substratul poros de forma tubulara cu diametrul de 12 mm si grosimea de 1 mm din ZrO2 stabilizat cu CaO, electrolitul sub forma de film de 40 μm din zirconiu stabilizat cu ytriu , iar la exterior este depus electrodul de combustibil (anodul) sub forma unei pelicule subtiri formata dintr-un cermet poros din niche si zirconiu de aprox. 150 μm. Functionarea se realizeaza prin trimiterea unui jet de aer prin interiorul pilei, iar la exterior se vehiculeaza amestecul carburant, conductia ionica realizandu-se cu ajutorul ionilor O2-. La o tensiune de 0.63 V s-a obtinur o inensitate de 28 A care corespunde unei densitati de curent de 0,25 A/cm2
( fig. 2).
Pile care utilizeaza alti combustibili decat hidrogenulDificultatile legate de producerea, stocarea si transportul hidrogenului, precum si pretul sau ridicat, au facut sa se dezvolte pile care folosesc drept combustibili alte substante. Pile cu hidrocarburi – sunt caracterizate printr-o slaba reactivitate chimica si o instabilitate a electrolitului in timp. Este de preferat utilizarea hidrocarburilor in pile indirecte.Pile cu alcooli si derivati oxigenati – au avantajul unei mai mari reactivitati a combustibililor si a unor preturi medii. Dintre toti monoalcoolii, doar metanolul poate reactiona complet pana la bioxid de carbon ( la temperatura joasa ). Performantele de putere ale acestor pile sunt comparabile cu ale acelora care functioneaza cu hidrocarburi.Pile cu derivati ai azotului. De cel mai mare interes se bucura pila cu hidrazina care are performante foarte bune in privinta puterii specifice, in plus, hidrazina se poate dizolva in electrolit, simplificand constructia pilei. Are dezavantajul ca este scumpa si degaja o cantitate mare de compusi cu azot. Amoniacul este avantajos ca pret, dar randamentul pilei este convenabil doar la temeperaturi medii; poate fi folosit atat direct, cat si indirect, cand se descompune in azot si hidrogen.
Pile speciale. In aceasta categorie pot fi incluse pilele regenerative cu metale alcaline si pilele redox:- pilele alcaline (regenerative) utilizeaza sodiul sau potasiul sub forma topita, circulate continuu, cu formarea intermediara a unor amalgame cu mercur. Puterea specifica este buna, dar necesita surse exterioare de caldura pentru regenerarea metalului alcalin ( se poate utiliza caldura reziduala de la centralele nucleare );- pila redox functioneaza prin asocierea unui generator electrochimic la fiecare electrod, rezultand de fapt, doua sisteme oxido-reducatoare separate, fiecare cu electrolitul sau ( fig. 3 ), oxidanti si sisteme de circulare proprii.Pile indirecte – utilizeaza combustibili care sufera transformari chimice sau fizice inainte de a intra in pila. De exemplu, carbunele reactioneaza cu aerul conform reactiilor:
1) C+CO2 2CO
2) 2CO+O2 2CO2

Astfel, reactia de oxidare completa a carbonului pana la bioxid de carbon este decompusa in doua trepte. Prima reactie are loc intr-un reactor de gazeificare, iar a doua are loc intr-o pila de combustie ( fig. 4 ).Bioxidul de carbon rezultat din pila de combustie este reciclat prin reactor, iar caldura care se degaja din reactia a doua poate fi folosita pentru mentinerea procesului din reactor deoarece prima reactie este puternic endoterma. Pila de combustie functioneaza la 800 - 1000°C cu un amestec de H2 si CO care rezulta din gazeificarea carbunelui. Electrolitul este solid, asa cum s-a aratat la pila de temperatura inalta.Incepand de la o anumita putere critica minima, degajarea de caldura devine suficienta pentru a compensa pierderile termice. Calculele arata ca, in cazul folosirii unor izolatii termice corespunzatoare, temperatura poate fi mnetinuta prin degajarea proprie de caldura.