Extragerea de rezultate - Curba deplasare la varf – forta ...
curba
-
Upload
irina-elena -
Category
Documents
-
view
2 -
download
0
description
Transcript of curba
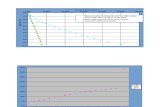
n timpul titrrii acido-bazice concentraia speciilor chimice ce iau parte la reaciile cantitative se modific pe parcursul tirrii. Reprezentarea grafic a unei proprieti de regul pH-ul, cu volumul soluiei titrate (%), n timpul titrrii se numete curba de titrare. Aceasta ajut la alegerea corect a indicatorului. Cu ct variaia de pH n jurul pE (punctul de echivalen) este mai mare, cu att titrarea este mai precis i posibiltile de alegere a indicatorului potrivit vor fi mai mari. La calcularea curbei de titrare ( indiferent de natura echilibrului chimic ce st la baza tirrii) se ntlnesc trei momente principale:-stadiul de dinaintea PE;-momentul punctului de echivalen PE;-stadiul dup PE.Curba de titrare poate fi:-liniar, cnd proprietatea urmrit-pH-ul este proporional cu concentraia substanei ce ia parte la reacie;-logaritmic, cnd proprietatea urmrit-pH-ul este o funcie logaritmic de concentraie.Problemele rezolvate mai jos reprezint un mod personal de abordare i nu anuleaz alte variante de rezolvare.Bibliografie:1.Donald J. Pietryk, Clyde W. Frank, Chimie analitic, Editura tehnic, 19892.Teodor Hodian, Claudia Cimpoiu, Iovanca Hodian,Sorin Hodian, Teorie i aplicaii n chimia analitic, Risoprint, Cluj Napoca , 2002;3. Vasilica Croitoru, Dan-Anghel Constantinescu, Aplicaii i probleme de chimie analitic; CURBA DE TITRARE N CAZUL TITRRII ACIZILOR TARI CU BAZE TARISe titreaz 100 mL soluie HCl 0,2 N cu o soluie de NaOH de aceai concentraie. a) S se calculeze pH-ul soluiei din paharul conic, la urmtoarele adaosuri de hidroxid de sodiu, la 220 C: 0,00 mL; 25 mL; 50 mL; 75 mL; 99,5 mL; 100 mL; 100,5 mL; 125 mL; b)S se traseze curba de titrare pH n funcie de variaia volumului de NaOH; c) S se calculeze saltul de pH n jurul PE pentru eroarea + 0,10 %.Varianta propus pentru rezolvaren timpul titrrii are loc reacia chimic de neutralizare:NaOH + HCl = NaOH + H2On biuret n paharul conicOBS:Concentraiile normale sunt egale cu cele molare, fiindc Eg=M;100 mL de soluie HCl 0,2 N va fi neutralizat de 100 mL soluie NaoH 0,2 N, la PE.CM = n moli/ V (L) = n mmoli/ V(mL)a) Calcularea pH-ului la diferitele volume de soluie NaOH 0,2 N adugat.1) V sol NaOH =0,00 mL, adic este nainte de a aduga NaOH din biuret peste soluia de HCl din paharul conic. n acest caz avem n paharul conic numai HCl, deci ioni de hidrogen:C M de HCl = C N = 0,2 MConcentraia molar a ionilor de H =[H] = [HCl] = 0,2 M(vezi reacia de ionizare a HCl)pH = -log [H] = -log0,2 = 0,6982) V sol NaOH 0,2 N =25 mL ; este nainte de PE.pH-ul soluiei este dat de cantitatea de ioni de hydrogen, care nu sunt neutralizai de cantitatea de NaOH introdus.mmoli de H+ iniiali= 100 mL x 0,2 M (mmoli/ mL) = 20 mmolimmoli de OH introdui = 25x 0,2 M = 5 mmolimmoli de H+ neutralizai de 5 mmoli NaOH = 5 mmolimmoli de H+ rmai = 20 mmoli 5 mmoli=15 mmoliV soluiei din pahar = 100 mL + 25 mL = 125 mL[H] = C H+ = 15 mmoli/ 125 mL = 0,12 MpH = -log 0,12 = 0,9213) V sol NaOH 0,2 N =50 mL ; este nainte de PE.pH-ul soluiei este dat de cantitatea de ioni de hidrogen, care nu sunt neutralizai de cantitatea de NaOH introdus.mmoli de H+ iniiali= 100 mL x 0,2 M (mmoli/ mL) = 20 mmolimmoli de OH introdui = 50x 0,2 M = 10 mmolimmoli de H+ neutralizai de 10 mmoli NaOH = 10 mmolimmoli de H+ rmai = 20 mmoli 10 mmoli=10 mmoliV soluiei din pahar = 100 mL + 50 mL = 150 mL[H] = C H+ = 10 mmoli/ 150 mL = 0,066 MpH = -log 0,066 = 1,1764. V sol NaOH 0,2 N = 75 mL ; este nainte de PE. pH-ul soluiei este dat de cantitatea de ioni de hidrogen, care nu sunt neutralizai de cantitatea de NaOH introdus.mmoli de H+ iniiali= 100 mL x 0,2 M (mmoli/ mL) = 20 mmolimmoli de OH introdui = 75 x 0,2 M = 15 mmolimmoli de H+ neutralizai de 15 mmoli NaOH = 15 mmolimmoli de H+ rmai = 20 mmoli 15 mmoli=5 mmoliV soluiei din pahar = 100 mL + 75 mL = 175 mL[H] = C H+ = 5 mmoli/ 175 mL = 0,028 MpH = -log 0,028 = 1,5445. V sol NaOH 0,2 N = 99,5 mL ; este nainte de PE. pH-ul soluiei este dat de cantitatea de ioni de hidrogen, care nu sunt neutralizai de cantitatea de NaOH introdus.mmoli de H+ iniiali= 100 mL x 0,2 M (mmoli/ mL) = 20 mmolimmoli de OH introdui = 99,5 x 0,2 M = 19,9mmolimmoli de H+ neutralizai de 19,9 mmoli NaOH = 19,9mmolimmoli de H+ rmai = 20 mmoli 19,9 mmoli= 0,1 mmoliV soluiei din pahar = 100 mL + 75 mL = 199,5 mL[H] = C H+ = 0,1 mmoli/ 199,5 mL = 0,0005 MpH = -log 0,0005 = 3,2996. V sol NaOH 0,2 N = 100 mL ; este la PE. Soluia conine numai sarea NaCl nehidrolizabil i nu se modific constanta de disociere a apei la 220 C; pH-ul soluiei este neutru (7). El rezult din:[H] = 1,00.10-14 = 1,00.10-7pH= -log 1.10-7 = 77. V sol NaOH 0,2 N = 100,5 mL ; este dup PE. pH-ul soluiei este dat de cantitatea de ioni de OH aflai n exces.mmoli de H+ iniiali= 100 mL x 0,2 M (mmoli/ mL) = 20 mmolimmoli de OH neutralizai = 20 mmolimmoli de OH introdui = 100,5 x 0,2 M = 20,1mmolimmoli de OH n exces= 20,1 mmoli -20 mmoli = 0,1V soluiei din pahar = 100 mL + 100,5 = 200,5 mmoli[H] = C H+ = 0,1 mmoli/ 200,5 mL = 0,00049 MpOH = -log 0,00049 = 3,309pH= 14-pOH= 10,6908. V sol NaOH 0,2 N = 125 mL ; este dup PE. pH-ul soluiei este dat de cantitatea de ioni de OH aflai n exces.mmoli de H+ iniiali= 100 mL x 0,2 M (mmoli/ mL) = 20 mmolimmoli de OH neutralizai = 20 mmolimmoli de OH introdui = 125 x 0,2 M = 25 mmolimmoli de OH n exces= 25 mmoli -20 mmoli = 5V soluiei din pahar = 100 mL + 125 = 225 mmoli[H] = C H+ = 5 mmoli/ 225 mL = 0,022 MpOH = -log 0,022 = 1,653pH= 14-pOH= 12,347V NaOH mL adugat025507599,5100100,5125
pH0,6980,9211,1761,5443,299710,69012,347
b) Curba de titrare
c) Calculul variaiei de pH n jurul PE pentru eroarea + 0,10 % se calculeaz astfel:( pH) 100 +/-0,1 = pH la (100mL de soluie NaOH 0,2 M +0,1mL) pH la (100 mL de soluie NaOH 0,2 M-0,1 mL)Unde:100=Volumul de NaOH 0,2 M la PE; el neutralizeaz 100 mL de soluie HCl 0,2 Mc 1) Calculm pH-ul pentru volumul de NaOH= 100-0,1=99,9 mLeste nainte de PE.pH-ul soluiei este dat de cantitatea de ioni de hidrogen, care nu sunt neutralizai de cantitatea de NaOH introdus.mmoli de H+ iniiali= 100 mL x 0,2 M (mmoli/ mL) = 20 mmolimmoli de OH introdui = 99,9 x 0,2 M = 19,98 mmolimmoli de H+ neutralizai de 19,98 mmoli NaOH = 19,98mmolimmoli de H+ rmai = 20 mmoli 19,98 mmoli= 0,02 mmoliV soluiei din pahar = 100 mL + 99,9 mL = 199,9 mL[H] = C H+ = 0,02 mmoli/ 199,9 mL = 0,0001 MpH = -log 0,0001 = 3,999c 2) Calculm pH-ul pentru volumul de NaOH 0,2 M = 100+0,1= 100,1 mL ;este dup PE.pH-ul soluiei este dat de cantitatea de ioni de OH aflai n exces.mmoli de H+ iniiali= 100 mL x 0,2 M (mmoli/ mL) = 20 mmolimmoli de OH neutralizai = 20 mmolimmoli de OH introdui = 100,1 x 0,2 M = 20,02mmolimmoli de OH n exces= 20,02 mmoli -20 mmoli = 0,02V soluiei din pahar = 100 mL + 100,1 = 200,1 mmoli[H] = C H+ = 0,02 mmoli/ 200,1 mL = 0,000099 MpOH = -log 0,000099 = 4,0002pH= 14-pOH= 9,999Deci:( pH) 100+-0,1 = 9,999-3,999=6