coloratii
-
Upload
danielle-nieves -
Category
Documents
-
view
45 -
download
0
description
Transcript of coloratii

Coloratii
A. Introducere, principii
Coloratia Gram
Dezvoltata initial de medicul danez Hans Christian Gram pentru diferentierea pneumoniei cu pneumococi de cea cu Klebisella ( 1884 )
Principiu:
1. Celulele Gram pozitive si Gram negative se coloreaza cu coloranti bazici ( ex. Crystal violet, violet de metil, numit si violet de gentiana)
2. Solutia de iodura de potasiu ( solutie Lugol) adaugata celulelor colorate cu crystal violet are ca rezultat formarea de complexe iodura-colorant de culoare mov, localizate in citoplasma celulelor.
3. Celulele G+ si G- se comporta diferit cand sunt tratate cu un agent de decolorare( ex. Amestec acetona-alcool sau alcool 95%). Celulele Gram + care au mult peptidoglican (mureina) in structura peretelui bacterian retin complexele, in timp ce celulele Gram -, care au un strat subtire de peptidoglican in perete nu. Diferenta intre cele + si cele – consta in permeabiltatea peretelui celular fata de acesti compusi colorant-iodura de culoare mov atunci cand sunt tratate cu solventi.
4. Pentru vizualizarea bacteriilor Gram – decolorate se utilzeaza o contracolorare cu un colorant rosu ( dex. Fucsina sau safranina), dupa decoloarare.
Culoarea celulelor Gram + si – in functie de etapa coloratiei
Etapa- timp Gram + Gram-Fixare prin caldura Incolor IncolorColorare cu crystal violet – 1-3’
Albastru Albastru
Fixare cu solutie Lugol 1-3” Mov MovDecolorare alcool-acetona 7-8”
Mov Incolor
Fucsina diluata 1/10 - 1 “ Mov rosu

Coloratia Ziehl-Neelsen
Principiu
1. Microorganismele care apartin genului Mycobacterium au o structura unica a peretelui celular, care contine acid mycolic, lipide si ceruri, in plus de peptidoglican.Aceste componente nu se pot colora cu coloratia Gram, asa cum de exemplu nu putem colora o lumanare de ceara daca o punem in contact cu un colorant.
2. Pentru colorarea mycobacteriilor se utlizeaza o coloratie mai dura, coloratia Ziehl- neelsen sau coloratia pentru bacili acid-alcoolorezistenti ( BAAR)
Pentru a facilita patrunderea in celula bacteriana a colorantului utilizat ( fucsina bazica nediluata) se pot adopta diferite proceduri:
- Incalzirea frotiului pentru topirea cerurilor din peretele bacterian- Utilizarea unor compusi chimici care permit patrunderea colorantului ( ex. Fenolul din
fucsina fenicata Kinyoun)3. Urmeaza un timp de decolorare cu acid alcool, care nu este eficient asupra celulelor cu
perete tipic mycobacteriilor. Acestea raman colorate. Celulele care nu sunt acid- alcool rezistente se decoloreaza sub actiunea amestecului acid-alcool.
4. Pentru vizualizarea celulelor decolorate (non – BAAR) se utilizeaza contracolorarea cu albastru de metilen.
Obs. Nocardia este un gen al carui perete celular este de asemenea foarte bogat in lipide. Se decoloreaza daca sunt colorate cu tehnica Ziehl- Neelsen clasica, dar utilizarea unei tehnici de colorare modificate prin utilizarea unui acid mai slab ( ex acid sulfuric 1%) pentru decolorare este utila pentru diferentiere de Genul Actynomyces. Prin coloratia Gram ambele tipuri apar ca bacili gram +, ramificati, in sirag de margele.
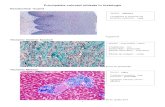
Coloratia May Grunwald Giemsa
Principiu: colorantii neutri, combinand colorantul bazic albastru de metilen cu colorantul acid eozina, acopera o gama larga de culori; ph-ul solutiei de colorare este critic si ideal trebuie ajustat in functie de diferitii fixatori utilizati. Nivele ale ph mai acide au ca rezultat o colorare mai selectiva a cromatinei si o bazofilie mai mica a citoplasmei; nivele ale ph mai putin acide au ca rezultat nuclei mai densi si bazofilie citoplasmatica mai accentuata. Nivelul ph ului trebuie sa se situeze intre 6,4 si 6,9.
Control : Splina

B. Materiale si echipamente- Lame curate de microscop
- Sursa de apa
- Apa distilata intr-un flacon cu dop rodat
- Proba de prelucrat
- Pensa metaliza
- Ansa bacteriologica
- Sursa de gaz
- Coloranti: albastru de metilen 3%, solutie violet de gentiana( crystal violet, violet de metil), solutie Lugol, solutie fucsina
- Servet de hartie
C. Protocolul de lucru
I.Prepararea frotiului
1. Plaseaza un film subtire din preparatul de examinat pe o lama curata de microscop, cu ajutorul ansei sterile sau a unui tampon. In cazul prelevatelor solide sau a coloniilor izolate din culturi pe mediul solid se omogenizeaza produsul de examinat cu o picatura solutie salina fiziologica sau apa distilata sterila.
2. usuca la aer, apoi fixeaza lama prin treceri succesive prin flacara ( lama nu trebuie sa fie fierbinte la atingere)
Obs. 1. Pentru a fi vizibile la MO, concentratia minima a microorganismelor trebuie sa fie de minimum 104-105 UFC/ml.
In cazul unor fluide presupuse a fi sarace in microorganisme, de ex LCR, se pot adopta urmatoarele strategii
- Centrifugare la turatie mica si colorare sediment- Depunere succesiva de picaturi in acelasi loc, cu uscare intre picaturi
Obs. 2. Frotiurile care nu sunt fixate corespunzator pot fi spalate in timpul colorarii si spalarilor, ceea ce are ca efect un rezultat fals negativ la investigarea microscopica.

Obs. 3. In cazul lichidelor incolore, greu de vizualizat pe lama, se poate marca locul de realizare a frotiului cu un marker scris pe sticla
Obs. 4. In cazul examinarii directe a sangelui pentru evidentiere de microorganisme, frotiul poate fi tratat dupa uscare la aer si fixare la cald cu apa distilata pentru 5 minute, urmat de spalare cu apa, pentru distrugerea si eliminarea hematiilor.
II. Coloratia Gram
1. Dilueaza fucsina intr-un recipient 9 parti apa distilata/ o parte fucsina2. Acopera frotiul ( nu toata lama) cu crystal violet, pentru 1-3 minute3. Indeparteaza colorantul prin inclinarea lamei si spalare cu apa de robinet4. Acopera frotiul cu solutie Lugol (mordant, fixator) pentru 1-3 minute5. Indeparteaza solutia Lugol prin inclinarea lamei si spalare cu apa de robinet6. Decoloreaza cu atentie un amestec alcool- acetona ( 1 parte acetona la 3 parti
alcool 95%) pana cand toate portiunile frotiului sunt incolore7. Indeparteaza amestecul alcool-acetona prin spalare insistenta cu apa de
robinet(critic)8. Acopera frotiul cu fucsina diluata 1/10 pentru un minut9. Indeparteaza fucsina cu apa de robinet10.Usuca la aer, pe un stativ de lame, in caz de urgenta tamponam cu hartie
absorbanta
Control de calitate
Se utlizeaza intotdeauna un martor sigur G+ si un martor sigur G-
III.Coloratia cu albastru de metilen
1. Acopera frotiul ( nu toata lama) pentru 3-4 minute cu solutie AM2. Spala cu apa distilata 3. Usuca la aer, pe un stativ de lame, in caz de urgenta tamponamcu hartie
absorbanta
IV. Coloratia Ziehl-Neelsen
1. Aseaza frotiul uscat si fixat pe un suport, deasupra tavitei de colorare2. Acopera complet lama cu fucsina bazica nediluata

3. Treci becul de gaz aprins pe sub lama acoperita cu colorant, pana incepe emiterea de vapori; ATENTIE, NU TREBUIE SA FIARBA! Se adauga colorant daca acesta se usuca; se repeta de 3 ori in 10 minute
4. Spala insistent cu apa distilata5. Adauga amestecul decolorant acid-alcool ( 3ml HCl contrat in 97 ml alcool
etilic 90-95%) pentru 2-3 minute6. Spala cu apa distilata7. Recoloreaza cu albastru de metilen 1 minute8. Usuca la aer, pe un stativ de lame, in caz de ugenta tamponam cu hartie
absorbanta.