UNIVERSITATEA DIN BUCURESTI -...
Transcript of UNIVERSITATEA DIN BUCURESTI -...
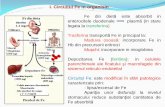
Digestia proteinelor exogene
Absorbtia intracelulara a aminoacizilor
Degradarea proteinelor endogene
1
La nivelul stomacului
Cardia – in principal celule secretoare de mucus Fundus (corpul) – celule parietale producatoare de acid, celule principale – proiducatoare de pepsinogen Pilor – productie de gastrina (hormon)
Functii
Amestecarea hranei cu acid/pepsina
Mediu acid (pH 1,5-2,0) necesita o bariera constituita dintr-o mucoasa gastrica superficiala, i n t e g r i t a t e a e p i t e l i a l a s i tamponarea cu bicarbonat
Activarea pepsinogenului
pepsinogen
pepsina + INP + 5 peptide inactive
MM 40,4 kDa
32,7 kDa 3 kDa
Se scindeaza 9 legaturi peptidice, modificari conformationale cu forma centrului catalitic activ
pH < 5
autocatalitic
Pepsina – endopeptidaza, pH optim 2-3, catalizeaza intr-o prima etapa hidroliza legaturilor peptidice la care participa prin gr carbonil resturile de Phe, Tyr, Trp
2
3
La o hidroliza mai indelungata exista si situsuri de atac minore
Produsii digestiei peptice: polipeptide peptice
La nivelul intestinului subtire
Isi varsa secretia pancreasul: 1,2 – 1,5 litri/zi, apa, electroliti (ioni bicarbonat), zimogene ale unor enzime proteolitice, amilaza, lipaze, etc (pH usor alcalin 7-8 neutralizeaza aciditatea gastrica
Zimogenele trec din RE in Ap. Golgi unde se acopera cu o membr lipoproteica formand asa numitele granule de zimogen - secretate un duoden ca urmare a unui semnal hormonal sau impul nervos
Intr-o prima etapa are loc activarea tripsinogenului la tripsina activa, care are loc sub actiunea enterokinazei, Ca2+ si autocatalitic
4
NH2 6 7 8 COOH
Lys-Ile-Val-
NH2 Lys COOH + NH2 Ile Val COOH
tripsinogen
tripsina
enterokinaza
Activarea tripsinogenului consta intr-un proces de proteoliza limitata, scindarea unei singure legaturi peptidice, indepartarea unei hexapeptide N-terminale si plierea polipeptidei C-terminale cu formarea conformatiei catalitic active
+ autocatalitic
Tripsina - erndopeptidaza, 24 kDa, actioneaza optim la pH 8,0 hidrolizand legaturile peotidice la care participa prin gr carbonil resturi de Lys si Arg
Substratele tripsinei – produsii peptici
Produsii hidrolizei tripsinei – produsii triptici
Tripsina incepe sa activeze celelalte zimogene:
chimotripsinogen chimotripsine
proelastaza elastaza
procarboxipeptidaze carboxipeptidaze
1 A 13 16 B 146 149 C 245
S-S S-S S-S
S S S S α
1 15 16 245 π S S
1 245 chimotripsinogen
chimotripsine
tripsina
Ser14-Arg15
Thr147-Asn148
5
6
Chimotripsinele – endopeptidaze – care scindeaza preferential legaturi peptidice la care participa prin grupari carbonil resturi: Tyr, Trp, Phe si Met
- familie de enzime (Nu! Izoenzime) formate prin proteoliza limitata, treptata, a zimogenului
- de la π α creste stabilitatea si scade activitatea
Elastaza – endopeptidaza care scindeaza legaturi peptidice la care participa prin grupari carboni resturi de aminoacizi mici: Gly, Ala, Val – denumirea de la substratul natural elastina din miofibrilele aortei
Carboxipeptidazele – exopeptidaze ce catalizeaza hidroliza resturilor de aminoacizi din pozitie carboxil-terminale
…….NH-CH-CO-NH-CH-CO-NH-CH-CO-…..NH-CH-CO-NH-CH-COOH
Ra Rb Rc Rn-1 R
Carboxipeptidaza A actioneaza nespecific; carboxipeptidaza B hidrolizeaza preferential resturi de Arg si Lys
7
Pancreasul este protejat contra activarii timpurii a zimogenelor prin 3 mecanisme:
1) Sinteza enzimelor proteolitice sub forma de zimogene;
2) Co-sinteza unor inhibitori naturali ai tripsinei, chimotripsinei, carboxipeptidazelor
3) Inglobarea precursorilor enzimatice in granulele de zimogen
8
Comparatie intre chimotripsina, tripsina si elastaza
40 % din structura lor primara identica
Structuri 3-D asemanatoare
Diferente mari la nivelul centrului catalitic activ
Evolutie moleculara divergenta Asp
Val Thr
chimotripsina
tripsina COO─-
elastaza
Phe,Tyr,Trp,Met
Arg+,Lys+
Gly
Comparatie chimotripsina, subtilizina
Enzime diferite care au suferit o evolutie moleculara convergenta privind solutia de a creste caracterul nucleofil din centrul catalitic activ al enzimei
102 57 195 chimotripsina
32 64 221 subtilizina
Asp His Ser
Transpeptidaza MP
NH2-CH-COOH
R
Glutation Cys-Gly
Cys γ-Glu-Cys
γ-glutamil aminoacid
5-oxoprolina
Glu
Gly ATP
ATP ATP 5-oxoprolinaza
Ciclul γ-glutamil la mamifere
Deficienta in 5-oxoprolinaza, acumulare de 5-oxoprolina, indivizi inapoiati mental
9
aminoacid
Degradarea proteinelor endogene in cadrul turnoverului proteinelor
– permite eliminarea proteinelor mutant sau pliate gresit (Hb normala – 120 zile; Hb mutante – minute)
- Modalitate de reglare a metabolismului (enzime comune – viata lunga; enzime reglatoare – viata scurta)
- Viteza degradarii proteinelor endogene depinde de starea nutritionala, de hormoni
2 cai de degradare a proteinelor
- Mecanismul neselectiv lizozomal (cu catepsine)
- Mecanismul selectiv citosolic, ATP-dependent, in complexe multienzimatice numite proteasomi
10
Degradarea lizozomala
-realizat cu catepsine – endoproteinaze de pH 5 si aminopeptidaze– care protejeaza celula contra scurgerii accidentale a enzimelor lizozomiale, care devin inactive la pH citosolic -experienţe cu derivaţi ai chininei – baze slabe care patrund in lizozomi in stare neincarcata, se protoneaza in lizozomi datorita pH lizozomial (5) unde inhiba functia lizozomilor -aceste studii au demonstrat care din proteinele endogene sunt degradate lizozomial Epuizarea musculara in cazul lipsei de miscare; Regresia uterului la nastere [ de la 2 Kg la 50 g in 9 zile] Diabet Traumatisme Artrita reumatoida Nu este afectata degradarea proteinelor anormale si cu viata scurta
11
Mecanism selectiv citosolic
Ubichitina
Proteina de 76 aminoacizi, 8,5 kDa
Termo-stabila
Pliata intr-o structura globulara
Gasita in toate celulele eucariote, proteina de la om si drojdie difera prin 3 aminoacizi
Implicata in multe proteine celulara
Implicata 2 etape:
Atasarea covalenta a unor multiple molecule de ubichitina la proteina condamnata (Pc)
Degradarea Pc marcate cu ubichitina si degradarea ei in proteasomul 26 S (ubichitina este reciclata)
12
Proteasomul organit “profesional” de degradare a proteinelor
are o activitate proteazica ATP-dependenta
reprezinta circa 1 % din proteinele celulare
prezent sub forma mai multor copii in citosol si nucleu
forma de cilindru gol de 20 S format din mai multe subunitati – unele sunt proteaze active cu centre catalitic active in interiorul cilindrului
Capetele cilindrului sunt asociate cu un complex proteic mare, 19 S cap, de circa 20 polipeptide distincte.
13
14
In celulele eucariote exista 2 tipuri de proteazomi: 20 S si 26 S
Proteazomul 26 S este compus din proteazomul 20 S si doi reglatori de 19 S (cap) cu activitate ATPazica
Mai mult de 80 % din proteine se pliaza incorect, scapa actiunii chaperonilor 1/3 din catenele polipeptidice nou sintetizate sunt selectate pentru degradare In cazul unor glicoproteine pliate necorespunzator, ele sufera translocare in citosol – unde sunt indepartate oligozaharidele sub actiunea unei N-glicanaze
16
E1 – enzima de activare a ubichitinei (Ub) Se formeaza o legatura tiol esterica macroergica int re Gly-COOH terminala din Ub si Cys din situsul activ al E1 (ATP/AMP) E2 – enzima de conjugare a Ub Ub este transferata la Cys din E2 cu formarea unei noi legaturi tiol esterice E3 – Ub ligaza Se formeaza o legatura izopeptidica intre gr COOH terminala a Gly-Ub si o grupare ε-amino dintr-un rest de Lys din proteina condamnata
18
Ub + ATP D Ub–AMP + PPi Ub–AMP + E1-SH D E1-S–Ub + AMP ______________________________ Ub + ATP → E1-S–Ub + AMP +PPi
Poli-ubichitinarea are loc sub actiunea altei enzime E4
Care catalizeaza adaugarea de resturi Ub la resturi Lys dintr-o alta molecula de Ub
19
Dezubichitinarea are loc sub actiunea unei enzime DUB (deubiquinating enzyme). Monomerii Ub pot relua ciclul
20
Ce determina ca o anumita proteina sa fie condamnata acestei degradari, sa fie ubichitinata selectiv ? Ce mecanism recunoaşte si degradeaza proteine anormale, incomplet sintetizate, pliate gresit, etc ?.
N-end rule
Odata Met indepartata, anumite resturi de aminoacizi N-terminale reprezinta semnale de recunoastere pentru calea ubichitinarii: Arg, Lys, His
Se pare ca E3 recunoaste aminoacizi specifici de la capatul N a unei proteine
Regula nu este universala
21